
Piotr Poniewierski, Anna Kostiukow, Włodzimierz Samborski
Klinika Reumatologii i Rehabilitacji, Uniwersytet Medyczny
im. K. Marcinkowskiego w Poznaniu
Streszczenie
Wstęp. Autyzm charakteryzuje komplet zaburzeń wczesnorozwojowych cechujących się nieprawidłowościami w obszarze komunikacji społecznej, brakiem lub ubogim za- interesowaniem otoczeniem czy też ubóstwem oraz stereotypowością powyższych zachowań. Jedną z dostępnych dla pacjentów autystycznych metod terapeutycznych jest hiperbaria tlenowa.
Cel pracy.
Celem pracy była ocena roli hiperbarii tlenowej w terapii dziecka zdiagno- zowanego z zaburzeniami ze spektrum autyzmu.
Materiał i metoda.
Badaniu poddano 60 pacjentów z diagnozą autyzmu. Terapia obejmowała 40 zabiegów hiperbarii tlenowej. Zabiegi były wykonywane w komorze hi- perbarycznej, ciśnienie 1,5 ata, czas ekspozycji na tlen to 60 min. Pacjenci byli oceniani według subiektywnej oceny rodziców testami CARS i CGI, przed przystąpieniem do terapii HBOT oraz po jej zakończeniu.
Wyniki.
Ponad połowa uczestników badania w subiektywnej ocenie rodziców (54%) doznała niewielkiej poprawy, a u 12% dzieci stwierdzono znaczną poprawę (CGI). Ciężka postać autyzmu przed terapia była widoczna u 43% uczestników, po zabiegach HBOT stanowiła 35 % dzieci (CARS). Kolejno lekki-umiarkowany poziom autyzmu przed terapią określono u 39% dzieci, po 30 % oraz pacjenci oceniani subiektywnie jako nieautystyczni przed kuracją stanowili 18%, po 35%. Dzieci po terapii HBOT posiadały niższy poziom au- tyzmu, niż przed przystąpieniem do zabiegów.
Wnioski.
Przeprowadzone badanie oparte na subiektywnej ocenie rodziców potwierdziło skuteczność prowadzenia tlenoterapii hiperbarycznej u dzieci ze zdiagno- zowanym autyzmem.
Słowa kluczowe: HBOT, hiperbaria tlenowa, autyzm
Wstęp
Autyzm jest określany jako zaburzenie heterogeniczne. Charakteryzuje ono stan patologii wczesnorozwojowych cechujących się nieprawidłowościami w ob- szarze komunikacji społecznej, brakiem lub ubogim zainteresowaniem otocze- nia, czy też ubóstwem oraz stereotypowością powyższych zachowań [1,2].Według badań i statystyk amerykańskiej organizacji zajmującej się badaniem spektrum autyzmu i zaburzeniami rozwojowymi (ADDM- Autism and Developmental Disabilities Monitoring), u jednego spośród 68 dzieci rozpoznaje się spektrum auty- zmu (ASD – autism spectrum disorder). ASD jest diagnozowane 4,5 raza częściej u chłop- ców, przypada na jednego chłopca wśród 42, natomiast u dziewcząt jest to jedna postawiona diagnoza na 189. Środowisko naukowe, statystycznie opisując liczbę rozpoznanego ASD, wskazuje na stały wzrost. Spektrum autyzmu jest schorzeniem najczęściej rozpoznawanym w Stanach Zjednoczonych, Szwecji czy Korei Południo- wej [3, 4]. Dodatkowo Amerykańska Akademia Pediatrii w informatorze z roku 2014 dla autyzmu informuje, iż u 1-2% dzieci zostanie zdiagnozowany autyzm [5].Spektrum autyzmu według Międzynarodowej Klasyfikacji Chorób ICD-10 jest przyporządkowane kodowi F84.0 (autyzm dziecięcy) oraz F84.1 (autyzm atypo- wy). Na podstawie analizy kodów ICD-10 określono częstość diagnozowania ASD w Polsce na 5,2-6,8 wśród 10 000 urodzonych dzieci [4,6]. Według najnowszych danych szacunkowych prowadzonych przez Fundację Synapsis w Polsce, osób ze zdiagnozowanym autyzmem jest co najmniej 30 000 [7].Złożoność omawianego zaburzenia nie bez przyczyny jest określana mianem spektrum. Leczenie dzieci z ASD wymaga holistycznego leczenia i rehabilitacji, w której uczestniczy cała rodzina. Pacjenci ci wymagają specjalnie ukierunkowa- nej fizjoterapii, pomocy pedagogicznej, psychologicznej oraz dietetyka.Wzrost stawianych diagnoz w przeciągu ostatnich 20 lat niejako wymusza na naukowcach i całym społeczeństwie poszukiwanie etiologii ASD [5].Wiele doniesień naukowych wskazuje na współistnienie dwóch czynników sprawczych etiologicznie wywołujących autyzm, którymi są, czynniki genetyczne oraz środowiskowe. Badania National Academy of Science potwierdziły, iż w 25% połączenie tych dwóch powyższych czynników (neurotoksycznych i genetycznych) jest odpowiedzialnych za wystąpienie autyzmu. Jednocześnie literatura naukowa jasno określa brak jednoznacznego, charakterystycznego czynnika sprawczego wy- wołującego ASD. Dotychczasowe badania genetyczne nie stwierdziły występowa- nia charakterystycznego genu odpowiedzialnego za rozwój autyzmu [8, 9].Hiperbaria tlenowa (HBOT- Hyperbaric Oxygen Therapy) – jest określana jako oddychanie 100 % tlenem w warunkach podwyższonego ciśnienia atmosferycz- nego w komorze hiperbarycznej [8].W komorze hiperbarycznej, gdzie panują warunki podwyższonego ci- śnienia atmosferycznego, zauważalny jest wzrost gradientu pęcherzykowo- włośniczkowego. W wyniku tego wzrostowi ulega rozpuszczalność tlenu w oso- czu. Dzięki temu procesowi również hemoglobina ulega całkowitemu wysyceniu tlenem. Wprost proporcjonalnie do wzrostu rozpuszczalności tlenu w osoczu rośnie siła dyfuzji między krwią, a tkankami [10].Opisany powyżej proces znajduje odzwierciedlenie w działaniu HBOT, do którego literatura medyczna zalicza: -zwiększenie procesu tworzenia nowych naczyń krwionośnych (angiogenezy); -działanie przeciwzapalne poprzez zminimalizowanie produkcji białek odpowie- dzialnych za mechanizm procesu zapalnego (CRP i cytokiny);-poprzez tworzenie nowych naczyń oraz zmniejszenie stanu zapalnego zwięk- szeniu ulega przepływ krwi; -zwiększenie aktywności enzymów wykazujących działanie przeciwutleniające, dlatego też hiperbaria wykazuje właściwości zmniejszające stres oksydacyjny; -dzięki tlenoterapii, wzrostowi ulega liczba mitochondriów oraz wzrasta aktyw- ność już istniejących organelli komórkowych;-regulacja i poprawa funkcjonowania układu immunologicznego; -wykazuje działanie antybakteryjne, antywirusowe oraz antydrożdżakowe; -odnotowuje się również zwiększoną produkcję komórek macierzystych w szpiku kostnym; -działanie antydepresyjne poprzez wzmożoną produkcję serotoniny [8,10,11].
Cel pracy
Celem pracy była ocena skuteczności hiperbarii tlenowej (HBOT) w terapii dziecka ze spektrum autyzmu.Metody badawczeDo ewaluacji efektów terapii wykorzystano dwa narzędzia pomiarowe w po- staci skal. Pacjenci byli oceniani według subiektywnej oceny ich rodziców zarów- no przed przystąpieniem do terapii HBOT, jak i po jej zakończeniu. Wykorzysta- no następujące skale: 1. Clinical Global Impression (CGI) [12,13,14], tj. Skala Globalnej Oceny Pacjen-ta, oceniająca trzy parametry: – Subiektywną ocenę skali ciężkości choroby przed rozpoczęciem leczenia oraz po zakończeniu leczenia. Określana jest według 7 stopni, gdzie 1 oznacza „zdro- wy”, a 7 „w stanie krytycznym”. – Subiektywną ocenę stopnia ogólnej poprawy po zakończeniu leczenia. Również jest oceniana według 7 stopni, gdzie 1 to „bardzo duża poprawa”, a 7 „bardzo duże pogorszenie” (Załącznik 1). 2. Childhood Autism Rating Scale (CARS) [15,16,17], tj. Skala Oceny PoziomuAutyzmu.
Dziecko w tej skali podlega ocenie w XV obszarach.Terapii poddano 60 pacjentów, którzy uczestniczyli w 40 zabiegach hiperbarii tlenowej. Wszyscy uczestnicy posiadali diagnozę autyzmu. Leczenie odbywało się w miękkiej komorze hiperbarycznej, gdzie ciśnienie terapeutyczne wynosi 1,5 ata. Na- tomiast czas ekspozycji na 100% tlen w podwyższonych warunkach wynosił 60 min. Procedura zabiegu obejmowała trzy fazy: 10-15 min wzrostu ciśnienia, 60 min wyrów- nanego ciśnienia do 1,5 ata (czas właściwej ekspozycji na tlen), 10-15 min dekompresji.
Wyniki
Analizę statystyczną wykonano w programie STATISTICA V12.5 PL. Interpre- tacja statystyczna skali CARS wykazała rozkład podobny do rozkładu normalne- go, co sugerowało wykorzystanie testów parametrycznych. Natomiast analiza skali CGI charakteryzowała się rozkładem niepodobnym do rozkładu normalne- go, co sugerowało wykorzystanie testów nieparametrycznych.W badaniu wzięło udział 60 pacjentów. Wszyscy pacjenci posiadali diagnozę au- tyzmu. Schorzeniami współistniejącymi u niektórych dzieci było: mózgowe poraże- nie dziecięce (2), upośledzenie umysłowe w stopniu lekkim (1), tetralogia Fallota (1).
Rozkład płci u badanej grupy wyglądał następująco: 10 kobiet tj. 16,67% ogółu i 50 mężczyzn, co stanowiło 83,33% wszystkich uczestników. Najmłodsze dziecko wśród badanych osób miało 25 miesięcy (2 lata), a najstarsze 192 mie- siące (16 lat), średni wiek badanych osób wyniósł M = 86 miesięcy (około 7 lat), z odchyleniem standardowym SD = 35 miesięcy (około 3 lata).W tabeli poniżej przedstawiono statystyki opisowe dla skali ciężkości choro- by badanych osób (CGI) przed rozpoczęciem terapii oraz po zakończeniu terapii (1 oznacza „zdrowy” natomiast 7 oznacza „w stanie krytycznym”) oraz stopień ogólnej poprawy (1 oznacza „bardzo duża poprawa” natomiast 7 oznacza „bar- dzo duże pogorszenie”) (Tabela 1, Wykres 1).
Tabela 1. Statystyki opisowe dla skali ciężkości choroby badanych osób (CGI) przed rozpoczęciem terapii HBOT, po zakończeniu terapii oraz stopień ogólnej poprawy


Wykres 1. Poziom skali ciężkości choroby badanych osób (CGI) przed rozpoczę- ciem terapii HBOT oraz po zakończeniu terapii, jak i stopień ogólnej poprawy.
Średni poziom ciężkości choroby przed rozpoczęciem terapii u badanych osób wyniósł M = 3,85 pkt. (z odchyleniem standardowym SD = 0,92 pkt.), średni poziom ciężkości choroby po zakończonej terapii wyniósł M = 3,7 pkt. (z odchyleniem standardowym SD = 1,03 pkt.), gdzie 1 oznacza „zdrowy” na- tomiast 7 oznacza „w stanie krytycznym”. Natomiast średni poziom ogólnej poprawy wyniósł M = 3,25 pkt. (gdzie 3 oznacza niewielka poprawa, natomiast 4 oznacza „bez zmian”).Najliczniejszą grupę (60%) stanowili pacjenci, których stan przed rozpoczę- ciem terapii HBOT został oceniony według subiektywnej oceny rodziców jako osoby chore, pacjenci bardzo chorzy stanowili 18% badanych, a osoby lekko cho- re liczyły 15% badanych osób. W tabeli poniżej przedstawiono rozkład skali cięż- kości choroby po zakończonej terapii (Tabela 2, Wykres 2).
Tabela 2. Rozkład skali ciężkości choroby po zakończonej terapii


Wykres 2. Rozkład skali ciężkości choroby po zakończonej terapii
Kolejną liczną grupę (50%) stanowili pacjenci, których stan po zakończonej terapii oceniano przez rodziców jako osoby chore, osoby bardzo chore stanowiły 18% badanych a osoby lekko chore stanowiły 22% badanych osób. Ponad połowa badanych według subiektywnej oceny rodziców (54%) doznała niewielkiej popra- wy, u 31% badanych opiekunowie nie zaobserwowali zmian, a u 12% badanych osób stwierdzono znaczną poprawę.W tabeli poniżej przedstawiono rozkład oceny poziomu autyzmu. Dzieci przystępujące do terapii były oceniane według subiektywnej oceny rodziców, przy pomocy skali Childhood Autism Rating Scale-CARS (Tabela 3, Wykres 3).
Tabela 3. Rozkład oceny poziomu autyzmu wśród dzieci przed terapią (CARS)


Wykres 3. Rozkład oceny poziomu autyzmu wśród dzieci przed terapią (CARS)
Wśród badanych przed terapią 43% to dzieci autystyczne w stopniu cięż-kim, dzieci autystyczne w stopniu lekkim-umiarkowanym stanowiły 39%.
Natomiast pacjenci według oceny rodziców (niezależnie od posiadanej dia- gnozy lekarskiej), zostały oznaczone w skali CARS jako nieautystyczne i sta- nowiły 18% badanych.Minimalny poziom skali CARS przed terapią wyniósł 18,5 pkt. a maksymalny 49 pkt. (minimalny możliwy do uzyskania wynik to 15 pkt. a maksymalny to 60 pkt.). Średni poziom skali CARS przed terapią wyniósł M = 35,25 pkt. (z odchyleniem standardowym SD = 6,65 pkt.). W tabeli poniżej przedstawiono rozkład oceny poziomu autyzmu wśród dzieci po terapii (Tabela 4, Wykres 4).
Tabela 4. Rozkład oceny poziomu autyzmu wśród dzieci po terapii (CARS)


Wykres 4. Rozkład oceny poziomu autyzmu wśród dzieci po terapii HBOT, na podstawie subiektywnej oceny rodziców, przy użyciu skali CARS
W subiektywnej ocenie rodziców wśród badanych po terapii HBOT 35% to dzieci autystyczne w stopniu ciężkim, dzieci autystyczne w stopniu lekkim- umiarkowanym stanowiły 30%, natomiast dzieci nieautystyczne według oceny rodziców (mimo posiadanej diagnozy lekarskiej o posiadanym autyzmie) w ska- li CARS stanowiły 35% badanych. Minimalny poziom skali CARS po terapii wy- niósł 18 pkt. a maksymalny 48 pkt. (minimalny możliwy do uzyskania wynik to 15 pkt. a maksymalny to 60 pkt.). Średni poziom skali CARS po terapii HBOT wyniósł M = 33,1 pkt. (z odchyleniem standardowym SD = 7,23 pkt.).W celu sprawdzenia, czy ciężkość choroby przed rozpoczęciem terapii i po zakończonej terapii (CGI) się różni, zastosowano test Wilcoxona. Analiza tym testem wykazała istotną statystycznie różnicę. Oznacza to, że badane osoby po terapii HBOT posiadały niższy poziom ciężkości choroby, według subiektywnej oceny rodziców, niż przed terapią HBOT.Następnie, w celu sprawdzenia, czy subiektywna ocena poziom autyzmu (skala CARS), która została przeprowadzona przez rodziców, przed terapią HBOT i po zakończonej terapii HBOT się różni, zastosowano test t-Studenta dla zmiennych zależnych.Analiza testem t-Studenta dla zmiennych zależnych wykazała istotną staty- stycznie różnicę. Oznacza to, że badane osoby po terapii HBOT posiadały niższy poziom autyzmu, niż przed terapią HBOT. Oceny dokonano na postawie subiek- tywnej opinii rodziców wyrażonej przez wypełnienie skali CARS. Analiza korelacji formularza CARS (przed i po terapii) oraz formularza CGI (przed i po terapii) wykazała zależność, że im badane osoby posiadały niższy poziom ciężkości cho- roby, tym posiadały niższy poziom autyzmu.Następnie poddano analizie szczegółowej wszystkie obszary funkcjono- wania dziecka, badane poprzez skalę oceny autyzmu CARS. Sprawdzono, czy według subiektywnej oceny rodziców, dziecko uległo poprawie, bądź pogor- szeniu, przypisując zmiany w zachowaniu dziecka według następującego sche- matu punktowego: – 0 pkt zmiany w skali przed przystąpieniem do terapii w stosunku do oceny po zakończeniu terapii HBOT opisano jako „bez zmiany”; – 0,5 pkt zmiany opisano jako „niewielkie pogorszenie”; – 1 pkt zmiany opisano jako „pogorszenie”; – 1,5 pkt zmiany opisano jako „znaczne pogorszenie”; – 2 pkt zmiany opisano jako „skrajne pogorszenie”; – 0,5 pkt zmiany opisano jako „niewielka poprawa”; – 1 pkt zmiany opisano jako „poprawa”; – 1,5 pkt zmiany opisano jako „znaczna poprawa”; – 2 pkt i więcej zmiany opisano jako „ponad oczekiwana poprawa”.Pierwszym badanym obszarem są relacje międzyludzkie (Wykres 5).

Wykres 5. Obserwowane zmiany w obszarze „relacji międzyludzkich” skala CARS
Analiza w obszarze relacji międzyludzkich, w subiektywnej ocenie rodzi- ców wykazała, iż u większości 31 pacjentów nie zauważono różnicy po terapii HBOT. Natomiast 8 opiekunów u swoich podopiecznych obserwowało niewielkie pogorszenie, bądź pogorszenie. Kolejne 17 osób widziało niewielką poprawę, 3 poprawę, a 1 poprawę ponad oczekiwanie.
Naśladownictwo/ imitowanie były kolejnym analizowanym obszarem w skali CARS (Wykres 6).

Wykres 6. Obserwowane zmiany w obszarze „naśladowania/imitowania” skala CARS
Analiza subiektywnej oceny rodziców w obszarze naśladowania wykazała, iż 32 uczestników nie zauważyło zmiany w badanym obszarze. Kolejno 11 pacjen- tów obserwowało niewielką poprawę, a 6 poprawę bądź znaczną poprawę i 2 pacjentów poprawę ponad oczekiwania. Natomiast 6 rodziców zaobserwowa- ło niewielkie pogorszenie, 3 pogorszenie.
Kolejnym analizowanym obszarem była odpowiedź emocjonalna (Wykres 7).

Wykres 7. Obserwowane zmiany w obszarze „odpowiedź emocjonalna” skala CARS
Interpretacja wyników w tym obszarze wskazuje, iż według subiektywnej oceny rodziców 17 dzieci nie uległo poprawie. Natomiast 12 opiekunów uważa, że ich podopieczni odznaczyli się niewielką poprawą, a 14 osób zauważyło po- prawę i 2 pacjentów znaczną poprawę. Jeśli chodzi o pogorszenie, to u 12 dzie- ci zauważono niewielkie pogorszenie, 1 pogorszenie i 2 znaczne pogorszenie w analizowanym obszarze odpowiedzi emocjonalnej.
Następnym obszarem analizowany w skali CARS było władanie ciałem/ użycie ciała (Wykres 8).

Wykres 8. Obserwowane zmiany w obszarze „władanie ciałem/ użycie ciała” skala CARS
W obszarze władania ciałem/użycia ciałem rodzice ocenili, iż u 29 dzieci nie zauważyli żadnych po terapii HBOT. Natomiast poprawę i niewielką poprawę za- obserwowano u 18 pacjentów. Niewielkie pogorszenie oraz kolejno pogorszenie i znaczne pogorszenie zostało odnotowane u łącznie 13 dzieci. Kolejnym obsza- rem oceniany subiektywnie przez rodziców było użycie przedmiotów (Wykres 9).

Wykres 9. Obserwowane zmiany w obszarze „użycie przedmiotów” skala CARS
W badanym obszarze użycia przedmiotów, 27 rodziców nie zauważyło zmian po terapii HBOT. Natomiast niewielką poprawę lub poprawę widziano u łącznie 8 pacjentów. Poprawa ponad oczekiwanie została zauważona u 1 pacjenta. Ro- dzice u swoich dzieci widzieli niewielkie pogorszenie, pogorszenie lub znaczne pogorszenie w sumie u 24 dzieci.
Szczegółowej analizie poddano również obszar adaptacji/ przygotowania się do zmian (Wykres 10).

Wykres 10. Obserwowane zmiany w obszarze „adaptacje/przygotowanie się do zmian” skala CARS
W obszarze adaptacji/przygotowania się do zmian, progresu w leczeniu po tera- pii HBOT nie obserwowano u 23 pacjentów. Rodzice u 25 swoich dzieci widzieli nie- wielką poprawę, poprawę, znaczą poprawę bądź poprawę ponad oczekiwania. Na- tomiast niewielkie pogorszenie widziano u 9 badanych dzieci, kolejno u 2 wystąpiło pogorszenie oraz u 1 znaczne pogorszenie według subiektywnej oceny opiekunów.
Następnie oceniono zmiany zachodzące w obszarze reakcji wzrokowych (Wykres 11).
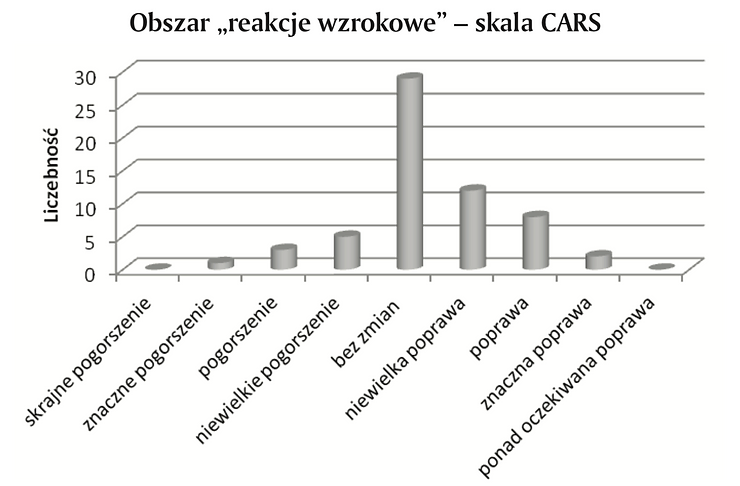
Wykres 11. Obserwowane zmiany w obszarze „reakcje wzrokowe” skala CARS
W obszarze reakcji wzrokowych zmiany nie zostały zaobserwowane u 29 dzieci, w subiektywnej ocenie rodziców. Natomiast niewielką poprawę, poprawę i znaczną poprawę widziano u łącznie 22 pacjentów. Niewielkie pogorszenie, pogorszenie i znaczne pogorszenie zaobserwowano w sumie u 9 osób.
Kolejnym badanym obszarem były reakcje słuchowe (Wykres 12).

Wykres 12. Obserwowane zmiany w obszarze „reakcje słuchowe” skala CARS
W obszarze reakcji słuchowych nie zauważono zmian u 27 pacjentów, w subiektywnej ocenie rodziców. Niewielka poprawa była widziana u 14, nato- miast poprawa i znaczna poprawa u łącznie 6. Jeden z rodziców zaobserwował poprawę ponad oczekiwania u swojego dziecka. Niewielkie pogorszenie i pogor- szenie zostało odnotowane w sumie u 12 osób.
Kolejnym obszarem poddanym interpretacji był obszar użycia zmysłów sma- ku, powonienia i dotyku oraz reakcji związanych z tymi zmysłami (Wykres 13).

Wykres 13. Obserwowane zmiany w obszarze „użycie zmysłów smaku, powonie- nia, dotyku, reakcje związane z tymi zmysłami” skala CARS
Analiza tego obszaru wykazała, iż zmiany nie były obserwowane u 25 pod- opiecznych. Natomiast niewielką poprawę, poprawę i znaczną poprawę widziano u 17 dzieci. Dwoje rodziców u swoich dzieci zauważyło poprawę ponad oczeki- wania. Znaczne pogorszenie, pogorszenie oraz niewielkie pogorszenie odnoto- wano w sumie u 15 pacjentów (subiektywna ocena rodziców).
Następnym anali- zowanym obszarem był strach/lęki i nerwowość (Wykres 14).

Wykres 14. Obserwowane zmiany w obszarze „strach/lęki i nerwowość” skala CARS
Analiza obszaru strach/lęki i nerwowość wykazała, iż 26 rodziców nie zauważyło zmiany u swoich podopiecznych. Natomiast w sumie 23 opiekunów zaobserwowało niewielką poprawę, poprawę, znaczną poprawę, w tym 2 poprawę ponad oczekiwa- nia. Niewielkie pogorszenie i pogorszenie widziano u łącznie 11 osób.
Komunikacja słowna była kolejnym analizowanym obszarem (Wykres 15).

Wykres 15. Obserwowane zmiany w obszarze „komunikacja słowna” skala CARS
Interpretacja subiektywnej oceny rodziców w obszarze komunikacji słownej pozwala stwierdzić, iż 32 rodziców nie zauważyło zmian u swoich dzieci w ba- danym obszarze. Natomiast niewielką poprawę, poprawę i znaczną poprawę widziano u 17 pacjentów. Opiekunowie zauważyli niewielkie pogorszenie u 5, pogorszenie u 5 i znaczne pogorszenie u 1 dziecka.
Kolejnym analizowanym obszarem jest komunikacja pozawerbalna (Wykres 16).

Wykres 16. Obserwowane zmiany w obszarze „komunikacja pozawerbalna” skala CARS
W obszarze komunikacji pozawerbalnej 28 rodziców nie zauważyło zmian u swoich dzieci. Jednak niewielką poprawę widziano u 15 pacjentów, a u 3 poprawę. Niewielkie pogorszenie oraz pogorszenie opiekunowie zauważyli u łącznie 14 dzieci.
Następnym badanym obszarem był poziom aktywności (Wykres 17).

Wykres 17. Obserwowane zmiany w obszarze „poziom aktywności” skala CARS
W obszarze poziomu aktywności 26 rodziców nie zaobserwowało zmiany u swoich dzieci. Natomiast w sumie 19 opiekunów widziało niewielką poprawę, poprawę lub znaczną poprawę. Pacjenci, którzy charakteryzowali się niewielkim pogorszeniem lub pogorszeniem stanowili łącznie liczbę 15.
Kolejnym analizowanym obszarem był poziom zwięzłości i logika odpowie- dzi intelektualnej (Wykres 18).

Wykres 18. Obserwowane zmiany w obszarze „poziom zwięzłość i logika odpo- wiedzi intelektualnej” skala CARS
Dwadzieścioro rodziców nie zauważyło zmiany u swoich dzieci po terapii HBOT w obszarze poziomu zwięzłości i odpowiedzi intelektualnej. Natomiast w sumie 26 opiekunów widziało zmianę od niewielkiej poprawy do poprawy ponad oczekiwania. Rodzice w swojej subiektywnej ocenie zauważyli u 11 nie- wielkie pogorszenie, pogorszenie u 2 oraz skrajne pogorszenie u 1 dziecka.
Ostatnim szczegółowo analizowanym obszarem w skali CARS jest obszar wrażeń ogólnych (Wykres 19).

Wykres 19. Obserwowane zmiany w obszarze „wrażenie ogólne” skala CARS
Rodzice w swojej subiektywnej ocenie u 39 dzieci nie zauważyli zmian po terapii HBOT. Niewielką poprawę obserwowano u 13 pacjentów, natomiast po- prawę u 3, a znaczną poprawę u 1. Dzieci odznaczających się niewielkim pogor- szeniem było 3, a 1 cechowało się pogorszeniem.W analizie szczegółowej największą poprawę zauważono w obszarze „odpo- wiedzi emocjonalnej”, gdzie liczba pacjentów o niewielkiej poprawie to 12, po- prawie 12 oraz znacznej poprawie 2 (Wykres 7). Natomiast obszar „użycia przed- miotów” oznaczył się największym pogorszeniem o czym świadczy 15 pacjentów z niewielkim pogorszeniem, 8 dzieci z pogorszeniem i 1 znacznie pogorszony wedle subiektywnej oceny rodziców (Wykres 9).
Dyskusja
Doniesienia naukowe z całego świata charakteryzują terapię HBOT jako skuteczną metodę, nie tylko stymulującą rozwój dziecka ze zdiagnozowanym ASD. Dzięki temu dziecko poddane terapii hiperbarycznej zyskuje większe szan- se na prawidłowy rozwój psychoruchowy w odniesieniu do grupy rówieśniczej, która nie brała udziału w terapii HBOT [8].Badania naukowców ze Stanów Zjednoczonych opisują skuteczność tera- pii HBOT w oparciu o skalę CGI. W zastosowanym protokole zabiegów, sesja terapeutyczna obejmowała 80 zabiegów. Wejścia do komory odbywały się raz dziennie z jednogodzinną ekspozycją na 100 % tlen w warunkach 1,5 atm. Po wykonaniu 20 zabiegów miała miejsce 4 tygodniowa przerwa przed kolejnymi zabiegami. Badanie to potwierdziło również efektywność działania HBOT w po- prawie parametrów skali CGI [12,18].Inne doniesienie naukowe pokazuje, iż hiperbaria tlenowa niskociśnienio- wa (1,3-1,5 atm) zwiększa perfuzję w obrębie naczyń krwionośnych mózgu. Na potwierdzenie powyższego zjawiska pacjentom biorącym udział w tera- pii wykonano badanie SPECT przed rozpoczęciem sesji terapeutycznych i po ich zakończeniu. Znaczące zmiany w obrębie mózgu pokazało badanie SPECT u dzieci, które otrzymały 50 codziennych sesji terapeutycznych w komorze hi- perbarycznej o ciśnieniu 1,5 atm z 60 minutową ekspozycją na 100 % tlen. Do- datkowo u niektórych pacjentów nastąpiła normalizacja pracy układu pokarmo- wego. Naukowcy również opisują polepszenie sprawności dzieci w obszarze funkcjonowania psychospołecznego. Najczęściej wykorzystywanym modelem ewaluacyjnym małych pacjentów przed zabiegami HBOT oraz po ich zakoń- czeniu, oprócz skali CGI są skale ATEC (Autism Treatment Evaluation Checklist) i skala CARS (Childhood Autism Rating Scale). Naukowcy zajmujący się bada- niem skuteczności terapii HBOT w leczeniu autyzmu określają, iż najskutecz- niejszym protokołem stosowanym w terapii jest: – 40 sesji terapeutycznych w komorze hiperbarycznej o ciśnieniu do 1,5 atm; – co najmniej jedno wejście dziennie do komory; – godzinna ekspozycja na 100 % tlen [19, 20, 21].Również i to badanie potwierdziło skuteczność terapii HBOT, w subiektywnej ocenie rodziców (wyrażonej w skalach CGI i CARS). Zauważalne efekty okazały się poprawą w funkcjonowaniu psychospołecznym dzieci z ASD.Terapia HBOT jest wsparciem przy włączaniu pacjentom diety bezglutenowej i bezkazeinowej. Parametry procedur zastosowanych dla opisywanego w piśmiennic- twie badania to: 1,3 atm, 60 min ekspozycji na 24 % tlen, 5 dni w tygodniu, nieprze- rwalnie przez 4 tygodnie [22]. Zastosowanie odpowiedniej diety, w tym również wy- eliminowanie alergenów, przekładało się na stan jelit, dzięki czemu poprawie uległa nie tylko praca układu pokarmowego dziecka, ale też całego organizmu [8].Rossignol w swoich wielu publikacjach wskazuje, iż dzięki działaniu HBOT poprawie ulegają parametry fizjologiczne charakterystyczne dla ASD. Po terapii hiperbarycznej zauważono następujące zmiany: – zwiększona perfuzja w obszarze mózgu;- złagodzenie stanu zapalnego systemu nerwowego; – złagodzenie gastroenterologicznego stanu zapalnego; – regulacja pracy układu odpornościowego; – obniżenie stresu oksydacyjnego; – poprawa działania mitochondriów; – poprawa mechanizmów działania neurotransmiterów; – poprawa funkcji enzymów detoksykacyjnych;
– obniżenie dysbiozy (patologiczna flora bakteryjna jelit); – wzrost komórek macierzystych oraz porfiryn [23].Zespół naukowców ze Stanów Zjednoczonych pod kierownictwem Jepson wykazał, że 40 zabiegów HBOT w komorze hiperbarycznej 1,3 atm z podażą 24 % tlenu jest niewystarczające do prowadzenia skutecznej terapii [24]. Do- wiedziono, iż znacznie skuteczniejszą jest terapia z wykorzystaniem ciśnienia powyżej 1,3 atm i z podażą tlenu większą niż 24 % [21].Mając na uwadze doniesienia naukowe, do terapii HBOT zastosowano ko- mory niskociśnieniowe 1,5 atm. W trakcie sesji w komorze hiperbarycznej pa- cjentom podawano czysty tlen z 60 minutową ekspozycją. Cykl terapeutyczny obejmował 40 zabiegów. Wykorzystano również narzędzia pomiarowe w postaci skal CGI i CARS, gdzie rodzice w sposób subiektywny oceniali swoje dzieci przed terapią i po jej zakończeniu.Interpretacja zabranych publikacji naukowych wraz z analizą wyników, prze- prowadzoną na cele tej pracy, pozwoliła potwierdzić skuteczność stosowania te- rapii hiperbarycznej w rehabilitacji dzieci z ASD.
Wnioski
Analiza wyników badanych pacjentów pozwoliła na postawienie następują- cych wniosków:Terapia HBOT wpływa na pewnego stopnia zmniejszenie ciężkości cho- roby oraz na obniżenie poziomu autyzmu (według subiektywnej oceny rodziców wyrażona w skalach CARS i CGI). Obszar największej poprawy, to obszar odpowiedzi emocjonalnej.
Zmiana wskaźnika „ciężkości choroby” (subiektywna ocena rodziców w skali CGI) w trakcie terapii hiperbarycznej nie wpływa na zmianę po- ziomu autyzmu (subiektywna ocena rodziców w skali CARS).W pracy stwierdzono, że kobiety nie różnią się od mężczyzn pod względem ciężkości choroby oraz poprawy choroby (CGI) jak i pozio- mu autyzmu (CARS).Stwierdzono, że osoby, które posiadają wyższy poziom poprawy w za- kresie wskaźnika „ciężkości choroby” (w skali CGI) posiadają również wyższy poziom autyzmu po terapii (CARS).
Bibliografia
1. Jackiewicz H.: Całościowe zaburzenia rozwojowe. W: Psychiatria dzieci i młodzieży. (red. I. Namysłowska). PZWL, Warszawa, 2012, 111.
2. Rajewski A.: Całościowe zaburzenia rozwoju. W: Psychiatria kliniczna. (red. A. Bilikiewicz, S. Pużyński, J. Rybakowski, J. Wciórka). Wydawnictwo Medyczne Urban & Partner, 2002, 645.
3. Christensen D., Baio J., Van Naarden Braun K., Bilder D., Charles J., Constatntino J., Daniels J., Durkin M., Fitzgerald R., Kurzius- Spencer M., Lee L., Pettygrove S., Robinson C., Schulz E., Wells Ch., Wingate M., Zahorodny W., Yeargin- Allsopp M.: Prevalence and Characteristics of Autism Spectrum Disorder Among Children Aged 8 Years. Autism and Developmental Disabilities Monitoring Network, United States 2012.
4. Prokopiak A.: Autyzm a odżywianie. O czym nauczyciele wiedzieć powinien. W: Lubelski Rocznik Pedagogiczny T. XXXII- 2013.
5. Harrington J., Allen K.: The Clinician’s Guide to Autism. W: Pediatrics in Review. American Academy of Pediatrics, USA 2014, 61- 78.
6. Jackiewicz H.: Całościowe zaburzenia rozwojowe. W: Psychiatria dzieci i młodzieży. (red. I. Namysłowska) PZWL, Warszawa 2012, 119-131.
7. Fundacja Synapsis: Skala, http://synapsis.org.pl/autyzm/skala , data wejścia:25.05.2017.
8. McCandless J.: Dzieci z głodującymi mózgami. Fraszka Edukacyjna, Warszawa 2007.
9. National Academy of Science Report, Stany Zjednoczone 2000.
10. Sieroń A, Cieślara G.: Zarys medycyny hiperbarycznej. Alfa-medica Press, Bielsko Biała 2006.
11. Materiały edukacyjno- informacyjne Centrum Hiperbarycznego Concept: Poznań; 2017.
12.. Bent S., Bertoglio K., Ashwood P., Nemeth E., Hendren R. Brief Report: Hyperbaric Oxygen Therapy(HBOT) in Children with Autism Spectrum Disorder, A Clinical Trial. Springer Science+BusinessMedia 2011.
13. Abnorm J., Lecavalier L., Smith T., Johnson C., Bearss K., Swiezy N., Aman M., SukhodolskyD., Deng Y., Dziura J., Scahill L.: Moderators of Parent Training for Disruptive Behaviors in YoungChildren with Autism Spectrum Disorder. Child Psychol 2016.
14. Kosaka H., Okamoto Y., Munesue T., Yamasue H., Inohara K., Fujioka T., Anme T., Orisaka M.,Ishitobi M., Jung M., Fujisawa T., Tanaka S., Arai S., Asano M., Saito D., Sadato N., Tomoda A., Omori M., Sato M., Okazawa H., Higashida H., Wada Y.: Oxytocin efficacy is modulated by dosage and oxytocin receptor genotype in young adults with high-functioning autism: a 24-week randomized clinical trial. Transl Psychiatry 2016.
15. Alhowikan A., Ayadhi L., Alkhedaide A.: Association of Learning and Memory Calcineurin Binding Protein with Autism Spectrum Disorders. Physicians Surg Pak 2017.
16. Wang J., Zou Q., Han R., Li Y., Wang Y.: Serum levels of Glial fibrillary acidic protein in Chinese children with autism spectrum disorders. Int J Dev Neurosci 2017.
17. Saad K., Abdel-Rahman A., Elserogy Y., Al-Atram A., El-Houfey A., Othman H., Bjørklund G., Jia F., Urbina M., Abo-Elela M., Ahmad F., Abd El-Baseer K., Ahmed A., Abdel-Salam A.: Randomized controlled trial of vitamin D supplementation in children with autism spectrum disorder. Child Psychology Psychiatry 2016.
18. Lemonnier E., Villeneuve N., Sonie S., Serret S., Rosier A., Roue M., Brosset P., Viellard M., Bernoux D., Rondeau S., Thummler S., Ravel D., Ben-Ari: Effects of bumetanide on neurobehavioral function in children and adolescents with autism spectrum disorders. Transl Psychiatry 2017.
19. Rossignol D., Bradstreet J., Dyke K., Schneider C., Freedenfeld S., O’Hara N., Cave S., Buckley J., Mumper E., Frye R.: Hyperbaric Oxygen treatment in autism spectrum disorders. Medical Gas Resacher 2012.
20. Ghanizadeh A.: Hyperbaric oxygen therapy for treatment of children with autism. A systematic re- view of randomized trials. Medical Gas Reseacher 2012.
21. Bennett M., Hart B.: UHMS Position paper the treatment of autism spectrum disorder with hyper- baric oxygen therapy.122 22. Whitehouse A.: Complementary and alternative medicine for autism spectrum disorders: Rationale, safety and efficacy. Journal of Paediatrics and Child Health. Royal Australian College of Physicians 2013.
23. Rossignol D.: Hyperbaric oxygen therapy might improve certian pathophysiological findings in au- tism. Elsevier 2006.
24. Jepson B., Granpeesheh D., Tarbox J., Olice M., Stott C., Braud S., Yoo H., Wakefield A., Allen M.: Controlled Evaluation of the Effects of Hyperbaric Oxygen Therapy on the Behavior of 16 Children with Autism Spectrum Disorders. Springer Science+Business Media 2010
żródło: https://www.wseit.edu.pl/images/upload/monografie/2018/art_10.pdf

